"CRISPR-Cas süsteemid" bakterites ja viirustes tuvastavad ja hävitavad sissetungivad viirusjärjestused. See on bakteriaalne ja arheaalne immuunsüsteem, mis kaitseb viirusnakkuste eest. 2012. aastal tunnustati CRISPR-Cas süsteemi kui a genoomi redigeerimistööriist. Sellest ajast alates on välja töötatud lai valik CRISPR-Cas süsteeme ja leidnud rakendusi sellistes valdkondades nagu geeniteraapia, diagnostika, teadusuuringud ja põllukultuuride parandamine. Kuid praegu saadaolevatel CRISPR-Cas süsteemidel on kliiniline kasutus piiratud, kuna sageli esineb sihtmärgiväliseid redigeerimisi, ootamatuid DNA mutatsioone ja pärilikke probleeme. Teadlased teatasid hiljuti uudsest CRISPR-Cas süsteemist, mis võib sihtida ja hävitada mRNA ja valgud seostada erinevate geneetiliste haigustega täpsemalt, ilma sihtmärgivälise mõju ja pärilike probleemideta. Nimega Craspase on see esimene CRISPR-Cas süsteem, mis näitab valk redigeerimisfunktsioon. See on ka esimene süsteem, mis suudab redigeerida nii RNA-d kui ka valk. Kuna Craspase ületab paljud olemasolevate CRISPR-Cas süsteemide piirangud, võib see muuta geeniteraapiat, diagnostikat ja monitooringut, biomeditsiiniuuringuid ja põllukultuuride parandamist.
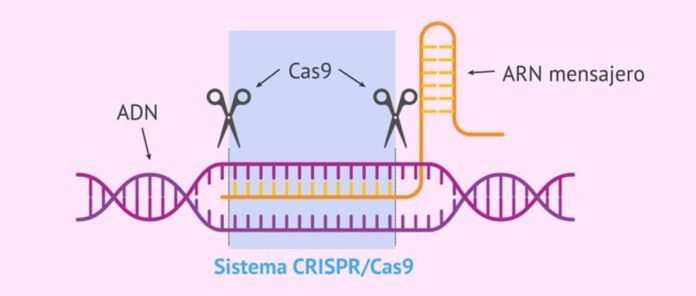
"CRISPR-Cas süsteem" on bakterite ja arheide loomulik immuunsüsteem viirusnakkuste vastu, mis tuvastab, seob ja lagundab kaitsmiseks viiruse geeni järjestusi. See koosneb kahest osast – bakteriaalsest RNA-st, mis transkribeeritakse pärast esimest nakatumist bakterigenoomi lisatud viiruse geenist (nimega CRISPR, mis tuvastab sissetungivate viirusgeenide sihtjärjestused) ja sellega seotud hävitajast. valk nimetatakse "CRISPR-iga seotud valk (Cas)”, mis seob ja lagundab tuvastatud järjestusi viiruse geenis, et kaitsta baktereid viiruste eest.
CRISPER tähistab "rühmitatud korrapäraselt interspaced lühikesi palindroomseid kordusi". See on transkribeeritud bakteriaalne RNA, mida iseloomustavad palindroomsed kordused.
Palindroomsed kordused (CRISPR-id) avastati esmakordselt järjestustes E. coli aastal 1987. 1995. aastal täheldas Francisco Mojica sarnaseid struktuure arhees ja just tema pidas neid esimest korda bakterite ja arhee immuunsüsteemi osaks. 2008. aastal demonstreeriti esimest korda eksperimentaalselt, et bakterite ja arheide immuunsüsteemi sihtmärk oli võõr-DNA, mitte mRNA. Viirusjärjestuste tuvastamise ja lagunemise mehhanism näitas, et selliseid süsteeme saab kasutada vahendina genoomi redigeerimine. Alates selle tunnustamisest genoomi redigeerimise tööriistana 2012. aastal on CRISPR-Cas süsteem jõudnud kindlalt väljakujunenud standardina väga kaugele. geeni redigeerimine süsteem ja on leidnud laia valikut rakendusi biomeditsiinis, põllumajanduses ja farmaatsiatööstuses, sealhulgas kliinilises geeniteraapias1,2.
Lai valik CRISPR-Cas-süsteemid on juba tuvastatud ja praegu saadaval DNA/RNA järjestuste jälgimiseks ja redigeerimiseks uuringute, ravimite sõeluuringu, diagnostika ja ravi jaoks. Praegused CRISPR/Cas-süsteemid jagunevad kahte klassi (2. ja 1. klass) ja kuut tüüpi (tüüp I kuni XI). 2. klassi süsteemidel on mitu Cas-i valgud mis peavad moodustama funktsionaalse kompleksi, et siduda oma sihtmärke ja tegutseda nende järgi. Teisest küljest on 2. klassi süsteemidel ainult üks suur Cas valk sihtmärkjärjestuste sidumiseks ja degradeerimiseks, mis muudab klassi 2 süsteemide kasutamise lihtsamaks. Tavaliselt kasutatavad 2. klassi süsteemid on Cas 9 Type II, Cas13 Type VI ja Cas12 Type V. Nendel süsteemidel võivad olla soovimatud kõrvalmõjud, st sihtmärgiväline mõju ja tsütotoksilisus3,5.
Geeniteraapiad Praegustel CRISPR-Cas süsteemidel on kliiniline kasutus piiratud, kuna sageli esinevad sihtmärgist väljas redigeerimised, ootamatud DNA mutatsioonid, sealhulgas suured DNA fragmentide deletsioonid ja suured DNA struktuurivariandid nii siht- kui ka sihtmärgivälistes kohtades, mis põhjustavad rakusurma. ja muud pärilikud probleemid.
Craspase (või CRISPR-iga juhitav kaspaas)
Teadlased teatasid hiljuti uudsest CRISPER-Cas süsteemist, mis on klassi 2 tüüpi III-E Cas7-11 süsteem, mis on seotud kaspaasitaolise süsteemiga. valk sellest ka nime saanud Craspase või CRISPR-juhitav kaspaas 5 (Kaspaasid on tsüsteiini proteaasid, mis mängivad võtmerolli apoptoosis rakustruktuuride lõhustamisel). Sellel on potentsiaalsed rakendused sellistes valdkondades nagu geeniteraapia ja diagnostika. Craspase on RNA-ga juhitud ja RNA-le suunatud ning ei puutu DNA järjestustesse. See võib sihtida ja hävitada mRNA ja valgud seostatakse erinevate geneetiliste haigustega täpsemalt ilma sihtmärgivälise mõjuta. Seega on haigustega seotud geenide elimineerimine võimalik mRNA või valgu tasemel lõhustamise teel. Samuti saab Craspase'i spetsiifilise ensüümiga seostatuna kasutada ka valkude funktsioonide muutmiseks. Kui selle RNaasi ja proteaasi funktsioonid eemaldatakse, desaktiveeritakse Craspase (dCraspase). Sellel ei ole lõikamisfunktsiooni, kuid see seostub RNA ja valgu järjestustega. Seetõttu saab dCraspase'i kasutada diagnostikas ja pildistamisel haiguste või viiruste jälgimiseks ja diagnoosimiseks.
Craspase on esimene CRISPR-Cas süsteem, mis näitab valgu redigeerimise funktsiooni. See on ka esimene süsteem, mis suudab redigeerida nii RNA-d kui ka valku. Selle geeni redigeerimine funktsioonil on minimaalsed sihtmärgist kõrvalekalduvad efektid ja puuduvad pärilikud probleemid. Seega on Craspase kliinilises kasutuses ja ravis tõenäoliselt ohutum kui teised praegu saadaolevad CRISPR-Cas süsteemid 4,5.
Kuna Craspase ületab paljud olemasolevate CRISPR-Cas süsteemide piirangud, võib see muuta geeniteraapiat, diagnostikat ja monitooringut, biomeditsiiniuuringuid ja põllukultuuride parandamist. Enne kliinilistes uuringutes ohutuse ja tõhususe tõestamist on vaja rohkem uuringuid, et töötada välja usaldusväärne manustamissüsteem, mis võimaldaks täpselt sihtida rakkudes haigusi põhjustavaid geene.
***
viited:
- Gostimskaja, I. CRISPR–Cas9: selle avastamise ajalugu ja genoomi redigeerimisel kasutamise eetilised kaalutlused. Biochemistry Moscow 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- Chao Li et al 2022. Arvutustööriistad ja -ressursid CRISPR/Cas genoomi redigeerimiseks. Genoomika, proteoomika ja bioinformaatika. Veebis saadaval 24. märtsil 2022. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. jt. RNA-le suunatud CRISPR-Cas süsteemid. Nat Rev Microbiol. 21, 21–34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Chunyi Hu et al 2022. Craspase on CRISPR RNA-ga juhitav RNA-aktiveeritud proteaas. Teadus. 25. august 2022. 377. kd, väljaanne 6612. lk 1278–1285. DOI: https://doi.org/10.1126/science.add5064
- Huo, G., Shepherd, J. & Pan, X. Craspase: uudne CRISPR/Cas kahe geeni toimetaja. Functional & Integrative Genomics 23, 98 (2023). Avaldatud: 23. märts 2023. DOI: https://doi.org/10.1007/s10142-023-01024-0
***